王晓刚课题组发现促进骨骼肌发育和再生的lnc-mg分子
2017-03
文章来自:admin 阅读次数:415
暨南大学生科院王晓刚副研究员带领的团队一直致力于运动系统退行性疾病的基础与转化医学研究。近年来取得了系列性成果,相继发表于Nature medicine(2013,19,93)、ACS Nano(2016,10,5759)、Nature communications(2017,8,14718)等刊物。
在国家自然科学基金面上项目和广东省自然科学基金杰出青年项目的资助下,王晓刚副研究员带领的课题组与同济大学孙瑶带领的课题组合作攻关,经过近五年的探索研究,发现并命名了一个促进骨骼肌发育与再生的长链非编码RNA分子(lnc-mg)。这一成果于2017年3月10日在线发表在《自然通讯》(Nature communications)杂志上。
随着我国社会老龄化加速,严重危害老年人身心健康的运动系统退行性疾病发病人数逐年增多。退行性疾病的病因非常复杂,参与因素众多。目前临床应用的一线药物大多针对已报道的明星蛋白分子而设计(如Wnt、RANKL、TGF-β等),长期使用,效果不佳,安全隐患大。2012年Encode计划发现,人类基因组的85%会被转录,除了编码蛋白的21000个基因相关的转录本外,剩余98%为非编码RNA转录本。非编码RNA被称为生命的“暗物质”,绝大多数分子的功能尚未被报道。尤其是在运动系统退行性疾病基础医学研究领域,非编码RNA的作用与机制研究,在国内外都处于起步阶段。目前,仅有少量的体外实验研究报道了非编码RNA在疾病中的作用,然而其体内的病理病生功能及作用的分子机制均未被揭示。因此,非编码RNA研究将有助于从全新视角认识运动系统退行性疾病的发生机制,切实推进新药的筛选和研发进程。
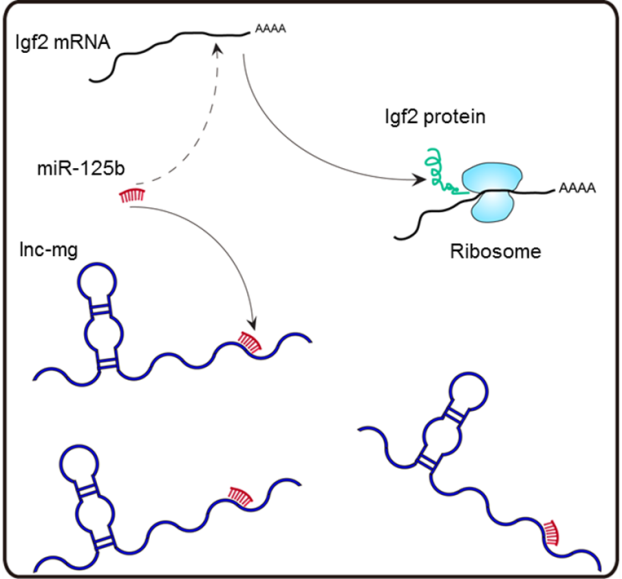
骨骼肌减少症(Sarcopenia)是一种增龄性肌肉退行性疾病,表现为骨骼肌萎缩、肌力和机体运动功能下降。目前,提高骨骼肌再生能力是对抗骨骼肌减少的主要策略。课题组以骨骼肌再生为切入点,率先筛选了骨骼肌干细胞分化过程中差异表达的长链非编码RNA分子(lncRNA),发现了一个新的lncRNA分子并命名为lnc-mg。lnc-mg可以促进骨骼肌干细胞分化和骨骼肌再生,其作用机制为竞争性结合miR-125b,从而增加Igf2的蛋白水平、激活骨骼肌干细胞分化和再生的下游信号通路。因此,课题组率先提出:新鉴定到的lnc-mg表达下调是骨骼肌减少症中肌肉再生障碍的重要原因,lnc-mg对miR-125b的抑制减弱,从而导致miR-125b活性增强,其靶基因Igf2蛋白水平下降是骨骼肌再生能力下降的核心机制(见下图)。
lnc-mg促进骨骼肌发育和再生的机制模式图
课题组率先发现并命名了一个新的lncRNA基因(lnc-mg),深入探讨了lnc-mg在骨骼肌再生过程中的作用和机制,构建了具有自主知识产权的lnc-mg基因敲除小鼠和lnc-mg转基因小鼠,为新发现的lnc-mg功能研究奠定了良好的物质基础。同时,课题组首次采用组学技术筛选受lnc-mg调控的miRNA分子,深入探讨了lnc-mg作为ceRNA发挥功能的分子机制,从而为ceRNA理论提供了坚实的实验证据。该分子的发现及机制研究有望为骨骼肌减少症的治疗提供新的药物靶点。
原文链接:
Lnc-mg is a long non-coding RNA that promotes myogenesis
http://www.nature.com/articles/ncomms14718?WT.feed_name=subjects_molecular-biology
原文摘要:
Recent studies indicate important roles for long noncoding RNAs (lncRNAs) as essential regulators of myogenesis and adult skeletal muscle regeneration. However, the specific roles of lncRNAs in myogenic differentiation of adult skeletal muscle stem cells and myogenesis are still largely unknown. Here we identify a lncRNA that is specifically enriched in skeletal muscle (myogenesis-associated lncRNA, in short, lnc-mg). In mice, conditional knockout of lnc-mg in skeletal muscle results in muscle atrophy and the loss of muscular endurance during exercise. Alternatively, skeletal muscle-specific overexpression of lnc-mg promotes muscle hypertrophy. In vitro analysis of primary skeletal muscle cells shows that lnc-mg increases gradually during myogenic differentiation and its overexpression improves cell differentiation. Mechanistically, lnc-mg promotes myogenesis, by functioning as a competing endogenous RNA (ceRNA) for microRNA-125b to control protein abundance of insulin-like growth factor 2. These findings identify lnc-mg as a novel noncoding regulator for muscle cell differentiation and skeletal muscle development.