薛巍教授课题组在级联响应型诊疗一体化精准递送方面取得进展
2018-05
文章来自:admin 阅读次数:1740
尽管影像介导的、刺激响应型的纳米递送系统用于肿瘤诊疗被认为有望替代传统治疗手段而受到广泛关注,但在载体设计中依然存在一些困境阻碍其进一步的转化。首先,尽管各种响应类型被开发出来并用于药物和基因递送系统,但是如何将多种响应介导的纳米性能(电荷,粒径或稳定性)的切换整合成一种级联形式来克服多级不同的生理屏障是个挑战,而且往往这些屏障在递送的不同阶段需要载体具备不同甚至是相反的性能。其次,一种刺激响应性一般只能引起一种载体性能的变化,那么能否实现通过一种刺激而引起多种载体性能的同步转变,从而协同促进其特异性递送?再次,对于一个成像和治疗一体的多功能化的诊疗平台,如何实现更为简便的制备也是一个挑战。
近期,暨南大学生物医学工程研究所薛巍教授课题组设计制备了一种由肿瘤微环境驱动的级联响应型的杂化荧光碳点用于基因的精准递送和影像追踪。该载体由带负电的可响应裂开的PEG外壳和聚阳离子功能化的碳点内核通过静电自组装制备得到。该荧光碳核以柠檬酸和聚乙烯亚胺(600Da)封端且分子内含大量二硫键的超支化聚酰胺胺(HPAP)作为碳源和钝化剂,通过一步微波法同步实现碳化和表面功能化。该方法不但赋予碳点可观的荧光量子产率(27%),且表现出细胞内降解能力和高效的基因递送能力。而外壳是由二甲基马来酸酐修饰的mPEG-PEI600共聚物构成,该结构表现出在肿瘤微环境下电荷翻转成正电而从功能化碳点表面脱离的能力。
该诊疗纳米平台表现出以下优势:首先是级联响应能力赋予载体对于多阶段生理屏障的自适应能力(1)一旦进入血液,PEG化外壳能有效延长循环时间;(2)从血液进入肿瘤组织,在弱酸条件下同步发生电荷翻转和粒径收缩而增强EPR效应来促进肿瘤特异性累积;(3)从组织到细胞内,谷胱甘肽引起HPAP的降解触发基因在肿瘤细胞内快速精确释放。其次,这种血液-组织-细胞三级响应纳米载体只需通过一步微波处理和后续的静电组装来简单制备。
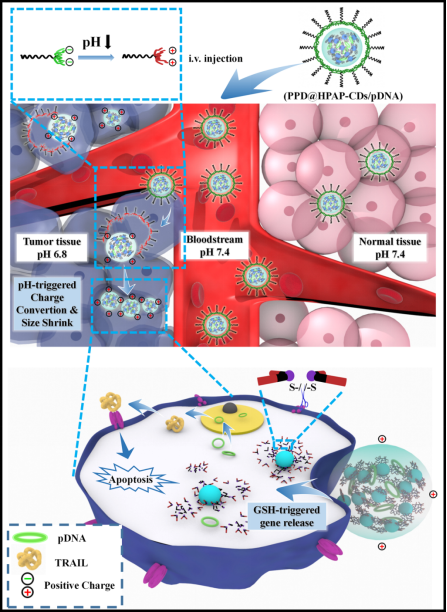
PPD@HPAP-CDs/pDNA肿瘤微环境和细胞内微环境中级联响应示意图
这一递送系统拥有影像可追踪、肿瘤特异性治疗基因递送能力和优异的生物相容性,从而为基于精准医疗的新型诊疗制剂的设计提供了一种多功能整合的方案。该研究成果近期发表在Chemistry of Materials(中科院JCR 1区,影响因子:9.466)上。暨南大学生物医学工程研究所硕士生赵海杰为该论文第一作者,张奕博士、刘宗华研究员和薛巍教授为该论文共同通讯作者。该研究同时得到国家自然科学基金和暨南大学科研培育与创新基金的资助。

