暨南大学何庆瑜/汪洋团队在抗癌靶向研究中取得系列重要进展
2023-07
文章来自:生命科学技术学院 阅读次数:674
在肿瘤恶性进展过程中,细胞器如溶酶体、线粒体等均扮演重要角色,因此,深入了解细胞器在肿瘤耐药及应激过程中的演变规律,并针对其进行靶向药物干预,能够有效抑制肿瘤进程。
[1] 溶酶体是含有多种水解酶的细胞器,通过内吞作用、吞噬作用或自噬降解细胞内和细胞外物质,维持细胞稳态和细胞存活。在肿瘤发展过程中,肿瘤细胞的溶酶体体积增大,活性加强,以满足肿瘤细胞快速生长及代谢需求。肿瘤中高度活跃溶酶体能够富外来药物,如索拉非尼等,从而导致肿瘤耐药。之前研究表明,肿瘤细胞在恶性转化过程中改变了溶酶体膜中的鞘磷脂含量,从而导致溶酶体肥大的现象,这样现象导致了肿瘤溶酶体膜的稳定性降低,容易产生溶酶体膜通透化(lysosomal membrane permeabilization, LMP)。根据这一特点可以开发特异性靶向药物,诱导溶酶体损伤,启动溶酶体相关细胞死亡,具有巨大治疗潜力。暨南大学生命科学技术学院何庆瑜/汪洋团队发现天然产物重楼皂苷D(Polyphyllin D,PD)通过结合酸性鞘磷脂酶(SMPD1)靶向肝癌(HCC)细胞肥大溶酶体,从而触发LMP相关的细胞死亡,此外,PD能够增强索拉非尼的抗肿瘤效果。该研究明确了PD抗肿瘤及克服索拉非尼耐药的作用及机制,为HCC提供了新的治疗选择与临床前数据,相关成果于2023年5月发表在Molecular Therapy (IF:12.9,一区Top)。
课题组博士生陈燕燕和高桂彬为文章并列第一作者。
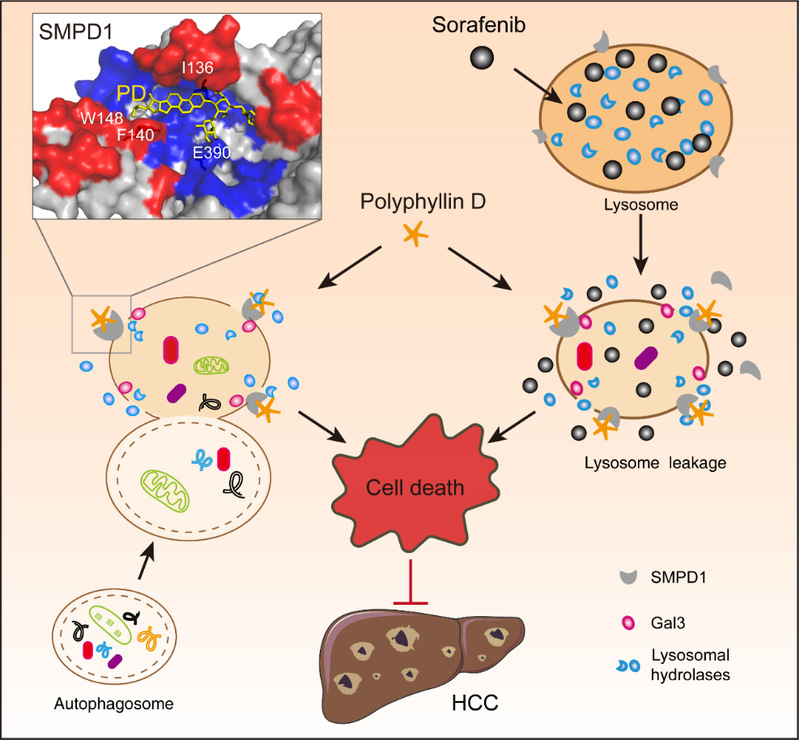
机理模式图(图源自Molecular Therapy)
[2]线粒体具有外周分裂和中间分裂两种分裂方式,决定着不同的细胞命运。特异靶向诱导线粒体过度非对称分裂相关细胞死亡(MFAD),是一种有前景的抗肿瘤治疗策略。近日,暨南大学何庆瑜/汪洋团队在Journal of Pharmaceutical Analysis(IF:14.02,一区Top)上发文,报道了去乙酰化酶抑制剂(HDACi)pracinostat作为一种新型MFAD诱导剂,在体内外实验中显示出对结直肠癌具有显著的抗癌作用。该成果揭示了pracinostat在结直肠癌中的特异靶向抗癌机制:通过促进细胞周期蛋白依赖性激酶5(CDK5)的表达并诱导其33位赖氨酸乙酰化,促进复合体CDK5/ p35诱导动力相关蛋白1(Drp1)介导线粒体外周分裂,导致肿瘤细胞死亡。这为开发潜在的结直肠癌治疗策略提供了新的范式。
课题组博士生梁晓玲和硕士生欧阳兰为文章并列第一作者。

机制示意图(图源自Journal of Pharmaceutical Analysis)
暨南大学何庆瑜/汪洋课题组诚招聘博士后,研究方向:抗肿瘤靶点发现及机制、蛋白质组学及肿瘤新抗原;有意者请准备应聘材料进行投递,应聘理由请注明“博士后应聘”。本招聘长期有效,欢迎有医学及生物学背景的青年人才加入,我们将致力于提供优越的学术研究平台,充足的自主探索空间和长期的职业发展支持,诚邀有志于学术研究的青年才俊加盟!
参考文献
[1] Wang Y, Chen Y Y, Gao G B, et al. Polyphyllin D punctures hypertrophic lysosomes to reverse drug resistance of hepatocellular carcinoma by targeting acid sphingomyelinase[J]. Molecular Therapy, 2023.
[2] Liang, X. L., Ouyang, L., Yu, N. N., et al. Histone deacetylase inhibitor pracinostat suppresses colorectal cancer by inducing CDK5-Drp1 signaling-mediated peripheral mitofission[J]. Journal of Pharmaceutical Analysis, 2023.
原文链接:
https://doi.org/10.1016/j.jpha.2023.06.005
https://doi.org/10.1016/j.ymthe.2023.05.015

