张弓研究组在《PLOS Genetics》发表翻译组学突破性文章
2016-06
文章来自: 阅读次数:857
2016年2月29日,国际著名学术杂志《PLOS genetics》上在线发表了暨南大学生命与健康工程研究院张弓、王通、何庆瑜教授课题组一篇最新翻译组学突破性研究成果,研究首次测定生理条件下所有基因的翻译延伸速率,实现了多种技术创新,终结了多项学界长期争论的问题。
研究首次实现了生理条件下人细胞内所有基因的翻译延伸速率测定,发现tRNA丰度是决定翻译速率的几乎唯一的因素,而传统上用于预测翻译速率的各项密码子偏好性指数与实测的翻译速率毫无关系。尤其是,该研究首次以实验证据表明,癌细胞可减慢促癌基因的翻译速率,进而保证这些基因产物的正确折叠,从而增强癌症表型;与之相反,癌细胞加速抑癌基因的翻译速率使其难以正确折叠而削弱其功能,从而维持癌细胞的恶性表型。
翻译调控是近年来被认为在生物信息流中具中枢地位。早在2001年,Pradet-Balade在综述中就指出,对翻译中mRNA的测定非常重要。2011年,Schwanh甀猀猀攀爀等人在Nature上发表论文,用数学模型证实翻译调控占从基因组到蛋白质组所有调控的一半以上,超过其他所有调控方式(包括转录调控、mRNA降解调控、蛋白质降解调控)的总和,是当之无愧的调控之王。因此,对翻译的全局研究显得尤为重要。但多年来,由于翻译组研究的技术困难,使得该领域的研究一直进展非常缓慢。2013年,暨南大学张弓、王通、何庆瑜课题组首次成功实现翻译组测序,对人细胞内翻译中的mRNA进行了全长定量测序,并发现翻译起始效率高的基因直接调控细胞特异性表型。
作为翻译调控的另一方面,翻译延伸速率的全局测定则更加困难。2011年,Jonathan Weissman等人使用ribosome profiling技术对小鼠胚胎干细胞进行了分析,他们使用一种药物阻止翻译起始,然后在不同时间点进行ribosome profiling,分析核糖体在mRNA上移动留下的空白区域的延长,测定出所有基因平均的翻译延伸速率约为5.6 codons/s。但该研究只能测定大量基因的平均翻译延伸速率,而无法实现单基因水平测定,而他们的结果显示不同类型基因的平均延伸速率并没有显著差异。此外,他们使用了药物阻止翻译起始,这是对细胞的严重干扰,会造成约60秒的延迟,因而观察到的并非生理状况下的翻译延伸。由于这些问题,他们的这种方法实际意义并不大,此后也未有人利用这种方法对翻译延伸进行系统研究。
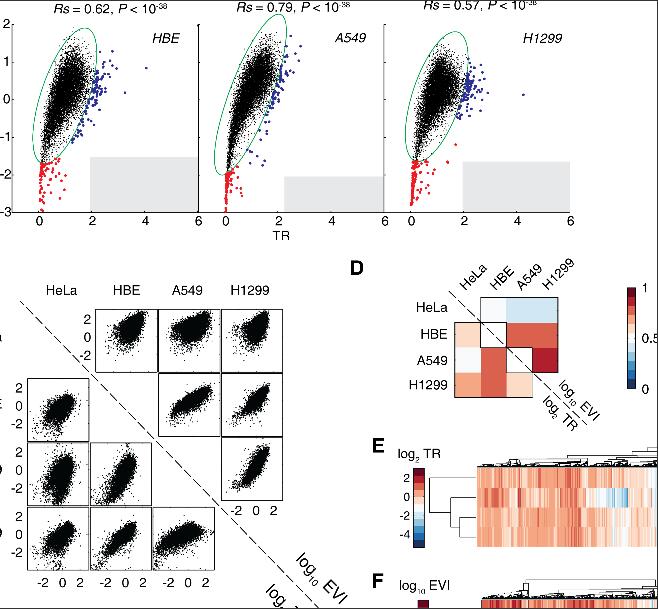
暨南大学团队则另辟蹊径解决了这一问题。藉由其在全长翻译组测序方面的技术优势,他们对同一细胞系同时进行了mRNA测序(mrna-seq)、全长翻译中mRNA测序(RNC-seq),以及核糖体足迹测序(ribosome profiling, Ribo-seq)。无需对细胞的正常生理状态作任何人工干预,这三大测序的数据可以直接计算出生理条件下每个基因的翻译起始效率(以翻译比例TR表征)和翻译延伸速率(以延伸速率指数EVI表征)。使用课题组自行研发的超高精度序列比对算法FANSe2对测序数据进行处理,他们在4株细胞(HeLa, HBE, A549, H1299)中测定了8000-10000个基因的翻译起始效率和EVI。
他们的研究结果表明,翻译起始效率和翻译延伸速率有一定的相关性,不存在翻译起始效率很高但翻译延伸很慢的基因,否则将会造成严重的核糖体“堵车”现象(ribosome jamming)而造成翻译资源的无端浪费。
他们发现了另一有趣现象,即不同的细胞内,翻译延伸减速的基因各不相同。这是什么造成的?自上世纪80年代以来,mRNA的二级结构是否对翻译延伸造成显著影响一直是一个广受争议的话题,正反双方的论文都不少,然而基本都是单个基因的分析,并未有一个全局性的结论。暨大此项全基因组级别的研究可能为这场大辩论画上一个句号:mRNA二级结构的稳定性对翻译延伸速率在全局上没有任何显著影响。此前还有一种观点认为,带正电荷的氨基酸会减慢翻译延伸速率,但此项研究证明,在多数细胞内,翻译十分缓慢的基因所带的正电荷氨基酸比例甚至要比全基因组的背景值还低,这推翻了此前的结论。在排除了众多因素之后,研究者发现tRNA浓度介导的密码子选择是几乎唯一的调控翻译延伸速率的因素,并鉴定出了翻译延伸缓慢基因所喜用的密码子,它们也呈现出很强的细胞特异性。而几十年来人们一直用来预测翻译延伸速率的各种密码子偏好指数,如codon adaptation index, codon bias index, tRNA adaptation index等与实测的翻译延伸速率毫无关系,不应再使用。
同一组织来源的不同细胞系之间,翻译延伸速率的调控是否有着生物学的意义?研究者对同样来自于肺的正常细胞和癌细胞进行了分析,发现癌细胞降低了一些基因的翻译速率,而这些基因的功能高度富集于癌症相关通路中。众所周知,癌细胞中tRNA丰度较高,蛋白质折叠效率普遍较差,未折叠蛋白质显著上升,然而这些翻译延伸速率相对下调的基因的蛋白质产量和未正确折叠的蛋白质都没有增加,证明下调翻译速率能有效保证这些癌基因蛋白的折叠,从而使这些癌基因正常行使其功能。与之相反,已知的抑癌基因在癌细胞中的EVI被上调,加快翻译延伸的结果是使抑癌基因难以正确折叠,从而难以发挥抑癌作用。这一正一反的翻译延伸调控,使得癌细胞巧妙地选择性地维持其恶性表型。
这项研究突破了翻译组学的一大技术瓶颈,使得人们从此可以精确对翻译延伸速率进行全局研究,并为翻译延伸调控的生物学意义提供了全新的视角。
Genome-Wide and Experimental Resolution of Relative Translation Elongation Speed at Individual Gene Level in Human Cells
原文链接:DOI: 10.1371/journal.pgen.1005901
原文摘要:In the process of translation, ribosomes first assemble on mRNAs (translation initiation) and then translate along the mRNA (elongation) to synthesize proteins. Elongation pausing is deemed highly relevant to co-translational folding of nascent peptides and the functionality of protein products, which positioned the evaluation of elongation speed as one of the central questions in the field of translational control. By integrating three types of RNA-seq methods, we experimentally and computationally resolved elongation speed, with our proposed elongation velocity index (EVI), a relative measure at individual gene level and under physiological condition in human cells. We successfully distinguished slow-translating genes from the background translatome. We demonstrated that low-EVI genes encoded more stable proteins. We further identified cell-specific slow-translating codons, which might serve as a causal factor of elongation deceleration. As an example for the biological relevance, we showed that the relatively slow-translating genes tended to be associated with the maintenance of malignant phenotypes per pathway analyses. In conclusion, EVI opens a new view to understand why human cells tend to avoid simultaneously speeding up translation initiation and decelerating elongation, and the possible cancer relevance of translating low-EVI genes to gain better protein quality.

