陈良课题组在《proceedings of national academy of sciences》上发表新型肺癌抑癌基因的原创性成果
2018-04
文章来自:admin 阅读次数:2960
肺癌是全球范围内的第一大癌。无论发病率还是致死率,在我国都是位列所有癌症之首。因为人们对肺癌癌变机理的认识,临床上治疗肺癌的手段已从早期仅有化疗可选,到了现在有靶向治疗等精准治疗。这主要归功于科学家们对肺癌中癌基因的认识。遗憾的是,仍然有一部分靶点阳性的病人对相应的靶向治疗不敏感。这提示癌基因以外的因素在影响着治疗的效果。抑癌基因的功能缺失能极大地影响肺癌细胞对药物的相应。抑癌基因是一个复杂的课题,目前对肺癌的抑癌基因尚未进行系统的研究。
我院陈良研究员一直致力于肺癌的临床转化研究,陈良实验室最近系统鉴定了肺癌的抑癌基因。为了回答这一问题,陈良教授实验室首先对病人的肺癌样品和癌旁组织样品中的基因表达进行了组学水平的分析,确定了肺癌中低表达的基因;通过文献调研,进一步确定了肺癌中功能尚未研究的基因;再通过临床资料的分析,确定了对病人生存有预测作用的基因。通过这三步分析,确定了55个潜在的新型肺癌抑癌基因。
陈良研究员实验室进一步利用肺癌的专基因小鼠模型在体验证这些基因的功能。他们利用同一个慢病毒同时表达Cre重组酶、CRISPR引导序列和CAS9 DNA切割酶。该病毒能通过Cre激活专辑小鼠肺上皮细胞中的突变Kras,CRISPRE/CAS9则能敲除肺上皮细胞中指定的基因。这个系统能高效地考察一个基因的敲除对肺癌形成是否具有促进作用。采用该系统,陈良实验室鉴定了5个新型的肺癌抑癌基因(Utx, Ptip, Acp5, Acacb, 和Clu)。
为了研究这些抑癌基因的发挥生物学功能的机理,他们将UTX的条件敲除小鼠和lsl-Kras G12D转基因小鼠交配。研究发现敲除UTX基因极大地促进了肺癌的进展,进一步研究发现UTX敲除促进了肿瘤内的EZH2的表达水平,从而提高肿瘤内的H3K27me3修饰水平。有趣的是,这些肿瘤对EZH2的抑制剂治疗敏感。
此项研究成果发表在《proceedings of national academy of sciences》上(In vivo CRISPR screening unveils histone demethylase UTX as an important epigenetic regulator in lung tumorigenesis,doi:10.1073/pnas.1716589115)。
陈良实验室博士一年级的学生田娅慧是本文的共同第一作者,陈良研究员是该论文的共同通讯作者。论文的署名单位有:中国科学院上海生物化学与细胞生物学研究所,暨南大学生命与健康工程研究院,纽约大学Langone医学中心,复旦大学,美国德州大学MD Anderson癌症中心,美国国家健康研究员(NIH)糖尿病与消化、肾病研究所和上海科技大学。
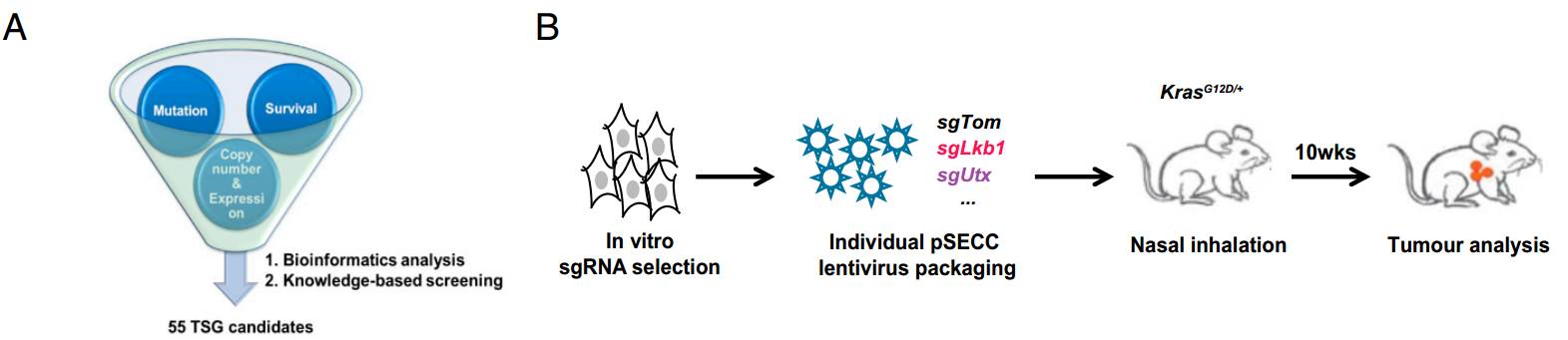
A.生物信息学结合临床数据确定肺癌抑癌基因候选基因。
B.体内筛选抑癌基因的流程示意图
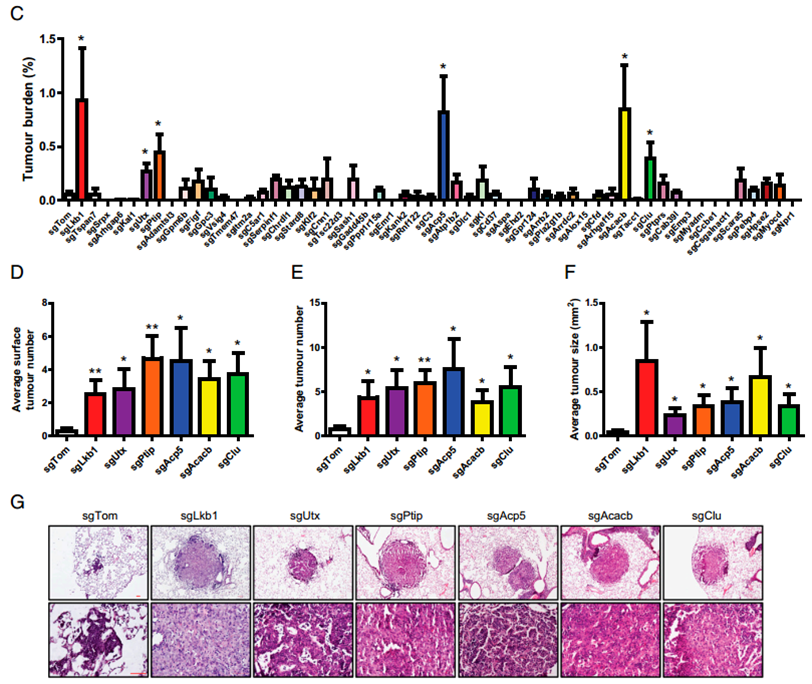
C.体内敲除候选基因后对lsl-Kras G12D转基因小鼠成瘤的影响
D.敲除候选基因后肺表面可见肺癌的数量
E.敲除候选基因后肺癌的直径
F.敲除候选基因后肺癌的病理染色结果
文章链接:http://www.pnas.org/content/early/2018/04/04/1716589115.short?rss=1
原文摘要:
Lung cancer is the leading cause of cancer-related death worldwide. Inactivation of tumor suppressor genes (TSGs) promotes lung cancer malignant progression. Here, we take advantage of the clustered regularly interspaced short palindromic repeats (CRISPR)/Cas9-mediated somatic gene knockout in a KrasG12D/+ mouse model to identify bona fide TSGs. From individual knockout of 55 potential TSGs, we identify five genes, including Utx, Ptip, Acp5, Acacb, and Clu, whose knockout significantly promotes lung tumorigenesis. These candidate genes are frequently down-regulated in human lung cancer specimens and significantly associated with survival in patients with lung cancer. Through crossing the conditional Utx knockout allele to the KrasG12D/+ mouse model, we further find that Utx deletion dramatically promotes lung cancer progression. The tumor-promotive effect of Utx knockout in vivo is mainly mediated through an increase of the EZH2 level, which up-regulates the H3K27me3 level. Moreover, the Utx-knockout lung tumors are preferentially sensitive to EZH2 inhibitor treatment. Collectively, our study provides a systematic screening of TSGs in vivo and identifies UTX as an important epigenetic regulator in lung tumorigenesis.

